Integrita lidského genomu je chráněna kontrolními mechanismy, které koordinují průběh buněčného cyklu a opravy DNA. V případě poškození DNA se buňky dočasně zastaví v kontrolním bodě buněčného cyklu, aby zabránily přenosu mutací na potomstvo, a po dokončení opravy DNA pokračují v proliferaci. Kontrolní bod a oprava DNA jsou úzce propojeny signálními kaskádami, které zahrnují fosforylaci proteinů (ATM, ATR, CHK1/2, CDK1, PLK1 kinázy), ubikvitinaci (BRCA1, RNF168, 53BP1) a expresi genů (nádorový supresorový protein p53). Deficitní kontrolní body buněčného cyklu nebo narušená oprava DNA umožňují proliferaci v přítomnosti poškozené DNA, což podporuje nestabilitu genomu a nakonec maligní transformaci. V naší laboratoři využíváme přístupy buněčné a molekulární biologie, editace genů pomocí technologie CRISPR/Cas9 a transgenní myší modely ke zkoumání buněčné odpovědi na poškození DNA. Hledáme také genetické defekty v nádorových buňkách, které by mohly být využity pro personalizovanou léčbu rakoviny.
Téma 1. Úloha PPM1D/WIP1 v reakci na poškození DNA a v onkogenezi
Proteinová fosfatáza PPM1D/Wip1 je důležitým negativním regulátorem nádorového supresoru p53 a podporuje ukončení kontrolního bodu buněčného cyklu. Vysoká exprese PPM1D/Wip1 je běžně pozorována u lidských nádorů, včetně rakoviny prsu. Již dříve jsme identifikovali novou gain-of-function mutaci v PPM1D/Wip1, která narušuje kontrolní body buněčného cyklu. Pomocí transgenního myšího modelu jsme nyní potvrdili schopnost této zkrácené formy PPM1D/Wip1 podporovat růst rakoviny. Kombinací proteomických přístupů, biochemie a buněčné/molekulární biologie zkoumáme mechanismy funkce PPM1D/Wip1 v lidských buňkách a hledáme její nové cíle v chromatinu. V neposlední řadě využíváme chemickou genetiku k vyhodnocení PPM1D/Wip1 jako potenciálního farmakologického cíle v terapii rakoviny.
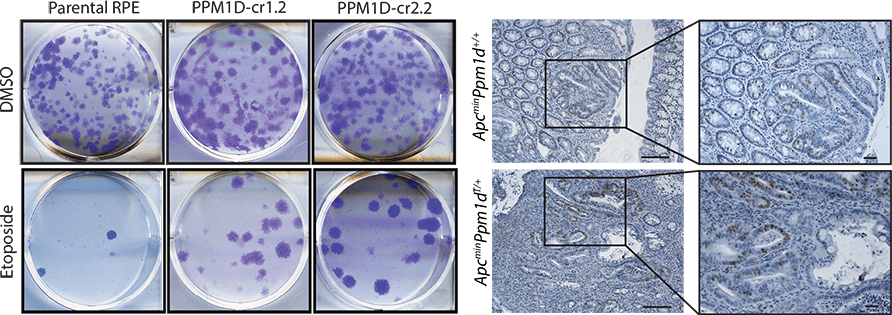
Téma 2. Identifikace nových genů predisponujících k rakovině
Geny pro opravu DNA a kontrolní body jsou typické nádorové supresory, které jsou u lidských nádorů běžně inaktivovány. Pokud jsou tyto mutace přítomny v zárodečné linii, mohou v postižených rodinách zvyšovat riziko vzniku rakoviny (např. BRCA1 nebo CHEK2 u familiárního karcinomu prsu). Varianty nejistého významu zjištěné sekvenováním NGS představují značný problém pro klinické hodnocení. Ve spolupráci s lékařskými genetiky vyvíjíme buněčné testy pro funkční hodnocení nově identifikovaných mutací, které umožní lepší prevenci familiárních nádorových onemocnění.
Téma 3. Úloha smyček R v genomové nestabilitě
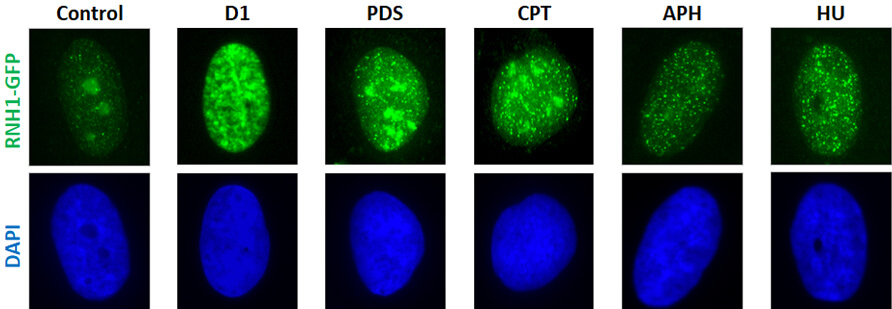
R-smyčky jsou trojvláknové struktury nukleových kyselin, které vznikají pronikáním vznikajícího transkriptu do duplexu DNA za transkripčním komplexem. R-smyčky se ukazují jako hlavní zdroj replikačního stresu DNA, genomové nestability a progrese nádorů. Používáme proteomické přístupy založené na hmotnostní spektrometrii a funkční screeny siRNA k identifikaci nových faktorů zapojených do metabolismu R-smyček a struktur G4 a studujeme jejich vztah k replikaci DNA a stabilitě genomu. Kombinací moderních molekulárně buněčných biologických metod a zobrazovacích technik se snažíme charakterizovat časné události spojené se zastavením replikační vidlice zprostředkované R-smyčkou. A konečně, používáme chromatinovou imunoprecipitaci a sekvenování nové generace k mapování R-smyček vytvořených onkogenem indukovaným replikačním stresem.
Téma 4. Screening nových proteinů zapojených do buněčného cyklu a mitózy
Pomocí expresního profilování v lidských netransformovaných buňkách jsme identifikovali nové předpokládané regulátory buněčného cyklu a mitózy. Deplece FAM110A narušila seřazení chromozomů v mitóze a vedla k chromozomálním defektům. Další analýza odhalila, že FAM110A se lokalizuje na pólech mitotického vřeténka a že tato lokalizace závisí na fosforylaci FAM110A kasein kinázou 1. V návaznosti na to nyní zkoumáme nové role kinázy CK1 v průběhu mitózy.